Sifat Koligatif Larutan
Larutan memiliki beberapa sifat fisis seperti warna, bau, rasa, rasa, pH, titik didih, titik beku, dan sebagainya. Nah teman-teman sifat fisis yang akan kita pelajari adalah sifat koligatif atau suatu sifat yang hanya tergantung pada konsentrasi partikel zat terlarut. Sifat koligatif tersebut terdiri dari penurunan tekanan uap, kenaikan itik didih, penurunan titik beku, dan tekanan osmosis.
Larutan memiliki beberapa sifat fisis seperti warna, bau, rasa, rasa, pH, titik didih, titik beku, dan sebagainya. Nah teman-teman sifat fisis yang akan kita pelajari adalah sifat koligatif atau suatu sifat yang hanya tergantung pada konsentrasi partikel zat terlarut. Sifat koligatif tersebut terdiri dari penurunan tekanan uap, kenaikan itik didih, penurunan titik beku, dan tekanan osmosis.
A.
Molalitas dan Fraksi Mol
1.
Molalitas
Molalitas menyatakan jumlah mol zat terlarut dalam 1000 gram pelarut. Molaritas dapat dinyatakan dengan rumus:
Molalitas menyatakan jumlah mol zat terlarut dalam 1000 gram pelarut. Molaritas dapat dinyatakan dengan rumus:
Untuk lebih jelasnya, perhatikan
contoh berikut!
2.
Fraksi Mol (X)
Fraksi mol menyatakn perbandingan
mol suatu zat dengan mol seluruh zat dalam larutan. Dalam campuran zat A dengan
zat B, maka fraksi mol masing-masing zat dapat dinyatakan dengan:
Jumlah fraksi mol seluruh zat dalam
larutan adalah 1.
Perhatikan contoh sola berikut:
B.
Penurunan Tekanan Uap ( P)
P)
Bila
teman-teman memanaskan air dalam ketel yang tertutup, maka ketika air mendidih
tutup ketel dapat terangkat, mengapa hal ini dapat terjadi? Apa yang enekan
tutup ketel tersebut, air apa uap airnya? Nah, dalam ruangan tertutup air akan
menguap sampai ruangan tersebut jenuh, yang disertai dengan pengmbunan sehingga
terjadi kesetimbangan air dengan uap air.
Perhatikan
tabel berikut:
Penurunan
tekanan uap merupakan selisih dari tekanan uap jenuh pelajut murni (PO) dengan tekanan uap
larutan (P).
Tekanan
uap ideal dapat dihitung berdasarkan hukum
Raoult : “tiap komponen dalam suatu larutan melakukan tekanan yang sama dengan
fraksi mol kali tekanan uap dari pelarut murni.”
Hubunga
tekanan uap jenuh larutan dengan tekanan uap jenuh komponen-komponen pada
larutan ideal (larutan-larutan encer) dapat digambarkan sebagai berikut:
Untuk
lebih memahaminya, perhatikan contoh soal berikut!
C.
Kenaikan Titik Didih ( Tb) dan Penurunan
Titik Beku (
Tb) dan Penurunan
Titik Beku ( Tf)
Tf)
-
Selisih antara titik didih larutan dengan titik didih pelarut murni
disebut benaikan titik didih ( Tb)
Tb)
-
Prubahan temperatur titik beku ini disebut penurunan titik beku larutan ( Tf).
Tf).
Perhatikan grafik berikut!
Pada larutan encer, kenaikan titik
didih dan penurnan titik beku berbanding lurus dengan konsentrasi molal
larutan.
Nah, untuk lebih memahaminya.
Perhatika contoh soal berikut:
D.
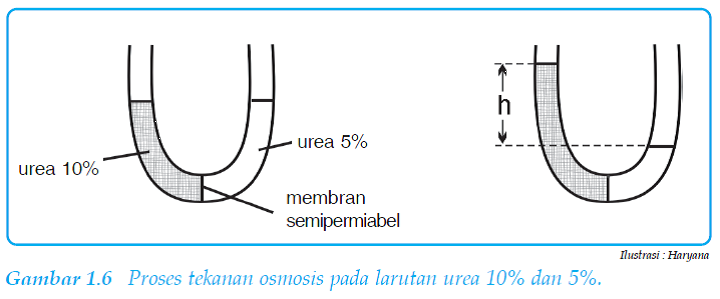
Tekanan Osmotik (π)
Osmosisi
adalah aliran suatu pelarut dari suatu larutan dengan konsemtrasi lebih rendah
ke larutan dengan konsentrasi tinggi melalui membran semipermiabel.
Perhatikan
proses osmisis berikut!
Peristiwa
osmosis dapat dicegah dengan memberikan tekanan pada permukaan larutan, tekanan
ini disebut tekanan osmisik. Tekanan osmisik bergantung pada konsentrasi dan
bukan pada jenis partikel zat terlarut.
Menurut
Van’t Hoof, tekanan osmosik larutan encer dapat dihitung dengan rumus yang
serupa dengan persamaan gas ideal:
Perhatikan
contoh soal berikut!
E.
Sifat Koligatif Larutan
Elektrolit
Berbeda
dengan zan nonelektrolit, zat elektrolit dalam air akan terurai menjadi ion-ion
sehingga dengan jumlah mol yang sama, zat elektrolit akan menghasilkan
konsentrasi partikel yang lebih banyak dibandingan zat non elektrolit. Satu mol
zat nonelektrolit dalam larutan menghasilkan 6,02 x 1023 partikel. Sementara
zat non elektrolit menghasilkan partikel yang lebih banyak.
Dengan
demikian untuk larutan elektrolit berlaku rumus berikut:
Perhatikan
contoh soal berikut:
Nah,
teman-teman untuk lebih menguasai tentang SIFAT KOLIGATIF LARUTAN, buka di
label Soal-Soal Kimia à Soal Koligatif Larutan dan coba kerjakan soal-soalnya! InsyaALLAH pasti
kalian bisa. Selamat Belajar
Semoga
bermanfaat.

































0 komentar:
Posting Komentar